这篇文章不是写口罩,也不是写FDA,写的是如何通过口罩的FDA快速找到供应商,快速判断FDA的真假。其实主要是写给现在想做出口口罩生意的各位。为什么是FDA,因为FDA是全球最高级别的食品和药物监管,甚至在办理CE和TGA以及其他认证的时候,有FDA也会比没有的要快很多。更重要的是,在CE和TGA的官网里没有FDA官网所具备的功能。
圈内最近对口罩是谈论的热火朝天,最近我们团队因为有订单出口美国这个事情,对FDA的这东西做了比较深入的研究。
这篇文章不是写口罩,也不是写FDA,写的是如何通过口罩的FDA快速找到供应商,快速判断FDA的真假。其实主要是写给现在想做出口口罩生意的各位。为什么是FDA,因为FDA是全球最高级别的食品和药物监管,甚至在办理
CE和TGA以及其他认证的时候,有FDA也会比没有的要快很多。更重要的是,在
CE和TGA的官网里没有FDA官网所具备的功能。
文章我会分为三部分,大概会阐述什么是FDA,怎么判断FDA,怎么使用FDA。当然了,要是作为外贸人或者你需要做口罩出口的,请着重留意第二第三部分。文章甚至还会有关于用FDA来进行工厂Sourcing的用法。
一. FDA认证是什么
美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA是美国政府在健康与人类服务部(DHHS)和公共卫生部(PHS)中设立的执行机构之一。作为一家科学管理机构,FDA的职责是确保美国本土生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品的安全。在国际上,FDA被公认为是世界上最大的食品与药物管理机构之一。
*然而,我们所说的FDA认证并非真的认证,而是一种注册或者登记。
这里补充知识点:这里只谈医疗器械,FDA将医疗器械划分为三个级别。I类、II类、III类。III类属于最高级别类目。
I类产品(占47%)
一般控制 绝大部分产品只需进行注册、列名和实施GMP规范(良好的生产规范),产品即可进入美国市场
中极少数产品连GMP也豁免,极少数保留产品则需向FDA递交510(K)(产品上市登记)申请即PMN(上市前的通告)
II类产品(46%)
一般控制 + 特殊控制, 企业在进行注册和列名后,这些产品除了上述一般控制之外,其余大多数产品均要求进行上市前通告(PMN:Premarket Notification)(即510K)。少量的II类产品可以豁免上市前通告程序。生产企业须在产品上市前90天向FDA提出申请,通过510K审查后,产品才能够上市销售。
降维补充:请记住,整篇文章我们都需要围绕口罩的话题来谈论。
N95 Respirator也就是
N95口罩这里属于II类,但是!!!在FDA里有一款
N95属于510(K)Exempt,也就是510(K)豁免,跟I类产品里GMP可以豁免一样的理解。
请参考FDA里对
N95的产品(其中一款)描述:

II类产品(7%)
一般控制 + 上市前许可(Premarket Approval) 企业在进行注册和列名后,须实施GMP并向FDA递交PMA(产品上市审核标准)申请(部分Ⅲ类产品还是PMN)。 一般来说, III类产品多为维持、支持生命或植入体内的器材,对病患具有潜在危险,可能引起伤害或疾病者,如心律调节器、子宫内器材及婴儿保温箱等,约占所有器材的8%。这些器材必须取得FDA的PMA之后方能销售。
Note:
对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业
对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。 至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。
综合以上内容可知,绝大部分产品在进行企业注册、产品列名和实施GMP,或再递交510(K)申请后,即可获得FDA批准上市。
*接着上面所说的FDA并非认证而是注册或者登记继续说,我们来看一下这三大类分类的流程,就能大概了解。
I类:填写资料—递交美国—交付年费—审批通过—完成工厂注册和器械列名。对于一类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业。整个流程只需要7天到15天
II、III类(以口罩为主):进行产品测试—准备PMN、PMA、510(文件)--递交FDA—FDA向企业发公告,同时发放企业以正式的市场准入批准函(Clearance)。整个流程快则需要2个月,慢则需要6个月。
注意:豁免的产品不在上述流程里,豁免产品流程以及时间,有待考究。
当然,好消息是,FDA官方发文,为有效对疫期扩散,缓解防护类产品的供应压力,针对防护设备(PPE)制作商,FDA会考虑加速审查生产地点变更或上市前申请—PPE(尤其是外科口罩和外科隔离服)。
我们可以清楚的看到,之所以说FDA不是认证,而是注册或者登记,就是因为FDA不会颁发任何的证书给到企业。市面上所谓的证书也就不攻自破。
这里还需要补充一个点:
美国对于医用口罩和工业防护口罩是区分管理的,其中医用口罩是由FDA掌控的,而防护口罩则有
NIOSH(National Institute for Occupational Safety and Health,美国国家职业安全研究所)管控。我们所说的
N95口罩就来源于
NIOSH对口罩分类中的一个类别。当然了,FDA在美国的权力巨大,NOISH也要听它的。
这里比较复杂,简单的来说,
N95属于防护类口罩比较低的品类,因此FDA决定将
N95中的一款划分为510(k)豁免。回到上面文章说II类产品的时候,不知道有没有发现我提到过一般控制+特殊控制,这里我们可以更简单的理解为
N95一般控制的是510(k),
N95特殊控制的为510(k)豁免。
刚刚说到FDA注册流程的时候提到,II类产品少则2个月,多则半年。那么为什么最近那么多厂家有FDA呢?除了按照整套流程走,还有另外2种途径:
(1) 已经获得
NIOSH批准的
N95口罩可以直接注册
如果你的
N95口罩获得了
NIOSH的批准,生物学测试、阻燃测试和血液穿透测试都通过了,那么你是可以豁免510K的,可以直接进行工厂注册和器械列名。
(2) 获得持有510K的制造商的授权,作为其代工厂使用其510K批准号进行企业注册和器械列名。
接下来要写一些比较硬核的东西了:
二. FDA官网,你以为它这么简单?
以下部分会分为两个部分,怎么使用FDA官网,怎么判断FDA的真假。但其实,只要你看懂怎么使用FDA官网,判断FDA真假也就小菜一碟。
1. FDA官网
没有语言选择,英语不好的可以自行下载插件翻译页面

我们在官网页面找到
Medical Device,然后点进去
我们来FDA官网上搜索一下关于
N95口罩在FDA的一些信息:
敲重点,这个地方的搜索很关键,搜出来的结果就能很直白的告诉你我上面所说的关于
N95的所有难点!!!我也会按照步骤再细分解释。用产品编码、关键词、注册的信息来搜索。
直接上操作,输入关键词
N95,出现的结果如下,出现了5个结果!!!证明
N95也分类。
补充:其实我们可以从英语描述就能大概知道这几个
N95的不同,我们可以看见最右侧一栏写着Device Class,正是用来区分I类、II类、III类的!
(1)Regulation Number这一栏,法规号码.
(2)这里我们可以看到编号是不同的,证明属于不同的法规。
(3)而这个法规编号侧是每个产品在所属的类别里有不同的法案。
(4)就拿这个作为例子,878.4040和880.6260,同属于II类又都是口罩,为什么会不一样?因为880.6260和878.4040这两个法规号码分属不同的法律条列管理,需要的检测报告也不一样。
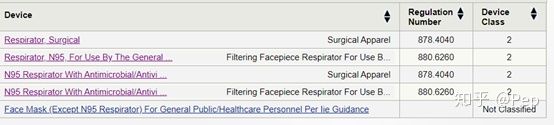
接着我们分别点进去来证明我说的,878.4040的两个产品:

接下来到880.6260,这两个看名字就很厉害了,
N95 Respirator With Antimicrobial/Antiviral Agent For Use By The General Public In Public Health
Medical Emergencies(
N95带有抗菌/抗病毒剂的呼吸器,在公共卫生医疗紧急情况下供公众使用)

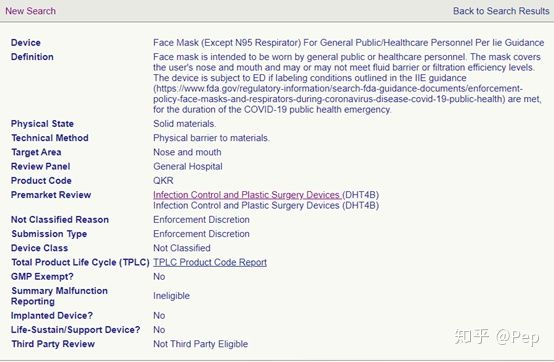
来到最后一个,让我哭笑不得,居然是个not classified的级别。。。点进去看完描述,懂了。 ‘面罩适用于一般公众或医疗保健人员。 面罩覆盖使用者的鼻子和嘴巴,可能达到或可能不达到流体屏障或过滤效率水平。 如果满足IIE指南中概述的标签条件,则在
COVID-19公共卫生突发事件期间,该设备将接受ED处理。’也就是说,这个QKR编号的
N95是FDA刚加进去的,来对付
COVID-19的。
1. FDA自带Sourcing功能?
弄清楚这个点,用FDA官网做Sourcing找到的供应商,效果绝不会比Alibaba差。首先在官网上找到的供应商一定是有做出口的,不然不会申请FDA,这一点要比1688强。其次官网上的供应商产品质量你能自己先做一次判断,FDA毕竟是国际级认证,而Alibaba不具有这个功能。当然了,我所指的也只是食品、药物、医疗器械、化妆品这类的产品。
下面就来说说怎么去找供应商
让我们跳转回进入官网之后的
Medical Device,来到Device Registration and Listing database。
里面所有的搜索条目分为:
机构名称或者商品名称
供应商名称
所有权名称
产品编号
机构所属州(US)
注册号码
供应商编号
产品描述名
机构类型
机构所属国家
!!!斜体字是最重要的几个搜索条目!!!
接着我们就用1.里的Product Code来进行搜索,这里要注意的是,机构所属国家填写中国。供应商名字搜索不建议用,因为搜索栏有字数限制,工厂名字一般贼长。
插播一条,国家搜索中国,我们可以看见港澳台地区的供应商,真的是爱了。
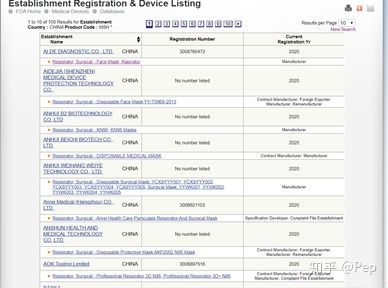
简单的来说会有这几个重要的信息:
工厂名、注册号码、注册年份、以及注册过的产品
这里掰开揉碎的拿出来讲这里面的信息以便我们容易去找供应商:
下面所说根据步骤来阐述
1. 注册号码,这是所有信息里最重要的,我们会看到其实有很多工厂都没有这个注册号码但是又有工厂信息显示在FDA里。原因很简单,回到FDA审核步骤,这类工厂提交了资料申请,只是FDA没有通过,但是因为工厂提交了申请,就必须给这个工厂编号。记住,这类工厂已经在FDA里有工厂编号了,在以后再次申请FDA是还会用这个编号,等到通过了,给个注册号码就行。所以,没有注册号码的企业也就意味着没有注册FDA,出口的时候就不能用这个FDA了,这种没有的直接Pass掉,选择有号码的。
2. 注册年份,当然是越早的越好,毕竟2020年注册的都是疫情爆发前后注册的,不少是原本并不是做这个行业的工厂。但是这里有个问题,搜索到的都是2020年的,我的猜想是因为FDA的有效日期一般是一年,所以当年搜到的都是当年申请的?这里不敢肯定,没有验证过。
3. 产品名称,这个比较重要,虽然我们用了一个产品编码,但是FDA的搜索会有这个产品编码类似产品以及一些类似品名的供应商信息(这个很不合理),所以我们需要查看工厂名称下面一栏的产品名称,查找是否这个已有注册号码的供应商是否有注册
N95这个产品。这里补充一下:一家供应商用一个注册号码可以注册不同的产品。这里聪明的人会问:为什么不用产品名称加产品编码的方法进行搜索,问的很好,亲测不行。这里我想多提醒一下,对这些有注册号码的工厂千万不能放过,因为你可能在产品名称栏看不到
N95但是你的搜索对象又是MSH,这个时候需要多做一个步骤以便不错过这家工厂,点进这家工厂获取它的工厂编号,直接退回搜索界面用它的工厂编号搜索这家工厂,之后则会弹出来这个工厂注册过哪几个产品编号,这样会比较稳妥。
4. 工厂名称,这个最简单,谷歌、panjiva、alibaba,发挥你们的想象。
5. 工厂类型,大概会分为Contract Manufacturer; Foreign Exporter; Manufacturer; Complaint File Establishment;Contract Sterilizer;Manufacturer;Remanufacturer;Specification Developer。

OK,来到最后一个栏目,510(k)Premarket Notification database.这个顾名思义就是找有510k级别的供应商。
同样先来看看里面的栏目,大同小异,会多几个可以勾选的选项。这个提到一个Panel一栏,口罩产品分属General Hospital.
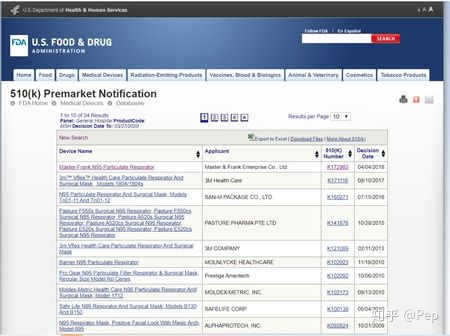
这里也会发现对这个
N95的描述也是有不同的,刚刚的注册号码也改成了510(k)number,多了一个时间年份升降序的操作,这一点上一级的搜索栏条目里就带。搜MSH离我们最近的时间2018年,究竟是没有更新了还是2019年没有企业申请呢?但也能理解,毕竟在CDC官网上找到的能生产
N95医用口罩的厂家全球也只有47家。
3.真金不怕火炼,真FDA不怕查。
我先总结一下市面上五花八门所谓的‘FDA证书’,各种水印,总结一下大概有这几种:
没有注册号,只有工厂信息和工厂编码,以及申请注册的产品,这类不能说是假的,只能说是申请不通过的类型。但是,因为申请不同这些就开始在这类‘FDA证书’上做文章了,懂行的会加上
N95的编码,不懂的只会加上
N95口罩这个名字。
从未注册过的商家,‘证书’上只有工厂和产品信息,最容易排除,傻瓜类
工厂信息是自己的工厂,注册号码和工厂是别人的工厂,这类是相当聪明的了.
真的‘FDA证书’,工厂名正确,注册号码无误,自己在证书上把
N95加了上去PS做出来,原本没有注册
N95这个产品,这类属于奸诈型的,需要小心
(1) 有了1.&2.的搜索功能作为基础,接下来的事情就显得十分的简单了。首先我们拿到工厂提供的FDA,拿到我们想要的得到的信息:注册号码和工厂编号,官网直接搜索就出来了
(2) 只要你泡在FDA官网上足够久,那么给你一份FDA一看名字就能判断是否有在你搜索过的列表。能用这种方法的建议直接考研,记忆力实在强大。
(3) 肉眼判断,其实有了第一点,第三点完全没有必要,只是为了给大家省点时间,拿到假的直接忽略掉,毕竟时间成本是宝贵的。大概就是拿到一份FDA先看注册号码,一般没有注册号码或者省略的可以忽略。再一个看产品名称跟产品编码是否吻合,比如说LYU是隔离服写成了
N95口罩,那也可以忽略掉。
分享一下这几种FDA的庐山真面目:
申请未通过的FDA




真的FDA

这里可以看到,写的是这家工厂成功注册FDA!

而这里则是注册成功的目录
NOISH 510(K)的FDA,直接是从人家官网找到的,这种就是所谓的真金不怕火炼,大大方方给你看。

这里再补充一个点:为什么现在这些FDA长得五花八门的,都不是一个样子?其实不能怪这些去PS的人,因为FDA有很多不同的检测机构,50个州都有,而且家机构所发的FDA函件各有不同,他们的函件代表着各自的机构,所以这就是为什么FDA都不长一个样子的原因,并不能用这个来判断真假
最近还有朋友问到我们关于
NIOSH的问题,其实上文也做过解释。有人问我们没有
NIOSH但是有FDA的
N95可以做出口吗?这个问题请去问FDA或者CDC。从我们所了解到的情况来看,是可以的。有一款FDA的产品编码已经属于510(K)豁免的,只需要做
NIOSH所需要的测试,省去上市前通告。因为在美国,FDA管着NOISH。

这里我的建议:
如果有任何想做医护用品出口美国的人,需要在前期做大量的准备工作,弄清出你要出口的那款产品的品名,再通过品名找到不同的产品编码,再弄清楚几个编码各自所属的类别,接下来需要用你所获取的编码信息去找到工厂,我的建议是把所有工厂mark下来,一个个去打电话。说实话,光是
N95口罩这个我已经花了很多天去研究透了,这不是一个小的工程量,一个人基本无法完成,如果是真的想出口,需要建立自己的团队,分工明确。
上文有任何不准确的地方欢迎指出,虚心请教;更欢迎讨论或者分享更好的经验。
最后还是想奉劝正在或想要出口的各位,首先你产品质量必须符合出口标准,其次你的各类还要齐全,毕竟这是救命的东西,不要想着在这种时期打擦边球,不然下一个北新建材的可能就是你。
转载于:知乎 Pep
----------------------------------------
【免责声明:转载的内容,主要目的在于分享信息,对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。如果您认为我们的授权或者来源标注与事实不符,或者侵犯了版权原作者所有者的权益,请及时告知我们,我们将在24小时之内删除。



















